Nội dung đang xem: Hóa học 10 Bài 12: Liên kết cộng hóa trị
Giải Hóa 10 Bài 12: Liên kết cộng hóa trị là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Kết nối tri thức với cuộc sống trang 55→62 thuộc Chương 3 Hóa 10.
Hóa 10 Bài 12 trang 55→62 sách Kết nối tri thức được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án. Vậy sau đây là giải Hóa 10 trang 55→62 sách Kết nối tri thức, mời các bạn cùng theo dõi tại đây.
I. Sự tạo thành liên kết cộng hóa trị
Câu 1
Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử.
a) Bromine (Br2).
b) Hydrogen sulfide (H2S).
c) Methane (CH4).
d) Ammonia (NH3).
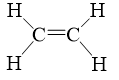
e) Ethene (C2H4).
g) Ethyne (C2H2).
II. Độ âm điện và liên kết hóa học
Câu 2
Dựa vào giá trị độ âm điện trong Bảng 6.2, dự đoán loại liên kết (liên kết cộng hoá trị phân cực, liên kết cộng hoá trị không phân cực, Liên kết cộng hóa trị ) trong các phân tử: MgCl2 , AlCl3 , HBr, O2 , H2 , NH3.
Gợi ý đáp án
Trong phân tử MgCl2
Hiệu độ âm điện của Mg và Cl: 3,16 – 1,31 = 1,85.
⇒ Liên kết giữa Mg và Cl là Liên kết cộng hóa trị .
Trong phân tử AlCl3
Hiệu độ âm điện của Al và Cl: 3,16 – 1,61 = 1,55.
⇒ Liên kết giữa Al và Cl là liên kết cộng hóa trị phân cực.
Trong phân tử HBr:
Hiệu độ âm điện của Br và H: 2,96 – 2,2 = 0,76.
⇒ Liên kết giữa Br và H là liên kết cộng hóa trị phân cực.
III. Mô tả liên kết cộng hóa trị bằng sự xen phủ orbital nguyên tử
Câu 3
Sự hình thành liên kết σ và liên kết π khác nhau như thế nào?
Gợi ý đáp án
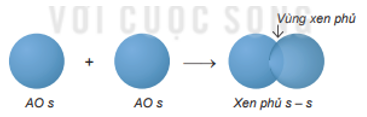
Sự xen phủ trục, tạo ra liên kết σ. Xen phủ trục là các orbital sẽ xen phủ với nhau theo trục liên kết. Có ba loại xen phủ trục:
Sự xen phủ s – s
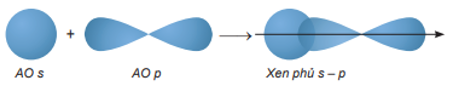
Sự xen phủ s – p
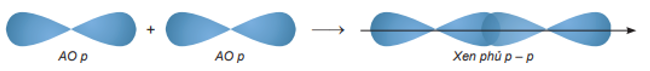
Sự xen phủ p – p
Sự xen phủ bên tạo ra liên kết π. Sự xen phủ bên là sự xen phủ, trong đó các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết.
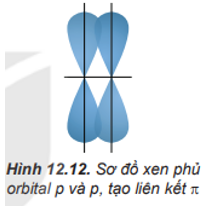
Câu 4
Số liên kết σ và π có trong phân tử C2H4 lần lượt là
| A. 4 và 0. | B. 2 và 0. |
| C. 1 và 1. | D. 5 và 1 |
Gợi ý đáp án
Đáp án D
Trong phân tử C2H4 có 5 liên kết σ và 1 liên kết π
IV. Năng lượng liên kết cộng hóa trị
Câu 5
Năng lượng liên kết là gì? Năng lượng liên kết của phân tử Cl 2 là 243 kJ/mol cho biết điều gì?
Gợi ý đáp án
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hoá học trong phân tử ở thể khí thành các nguyên tử ở thể khí. Năng lượng liên kết đặc trưng cho độ bền của liên kết.
Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết: để phá vỡ 1 mol liên kết Cl – Cl thành các nguyên tử Cl (ở thể khí) cần năng lượng là 243 kJ.
Câu 6
Dựa vào giá trị năng lượng liên kết ở Bảng 12.2, hãy chọn phương án đúng khi so sánh độ bền liên kết giữa Cl2, Br2 và I2.
A. I2 > Br2 > Cl2.
B. Br2 > Cl2 > I2.
C. Cl2 > Br2 > I2.
D. Cl2 > I2 > Br2.
Gợi ý đáp án
Đáp án C
Dựa vào Bảng 12.2, ta thấy, năng lượng liên kết Cl – Cl > năng lượng liên kết Br – Br > năng lượng liên kết I – I.
⇒ Độ bền liên kết giảm từ Cl2 > Br2 > I2.
[ad_2]
Đăng bởi: THPT An Giang
Chuyên mục: Học Tập
